lundi, 26 mars 2012
Des oligomères pour maintenir la trace de nos souvenirs
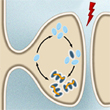
Une protéine ayant la capacité particulière de pouvoir s’empiler sur elle-même (comme des boîtes d’œuf, par exemple) pourrait bien, grâce à la grande stabilité des courtes chaînes ainsi obtenues, constiuer un élément clé des mécanismes permettant de garder une trace durable de nos souvenirs.
Car se rappeler d’un souvenir auquel on n’a pas pensé depuis plusieurs décennies a toujours quelque chose de magique. Sous quelle forme la trace mnésique correspondante s’est-elle maintenue tout ce temps dans notre cerveau ? Les neurobiologistes savent que tout se passe au niveau de la synapse, c’est-à-dire la connexion plastique entre deux neurones. Et ils ont décrit des mécanismes comme la potentialisation à long terme qui permet de comprendre en partie cette plasticité au niveau moléculaire.
Mais il manque encore des pièces à ce puzzle. En particulier au niveau des phénomènes moléculaires capables de résister aux assauts du temps dans un environnement moléculaire en constante dégradation et reconstruction. Une étude menée par Amitabha Majumdar et ses collègues publiée le 27 janvier dernier dans la revue spécialisée Cell, indique un mécanisme probable derrière la stabilité de la trace mnésique.
L’étude révèle que la quantité d’oligomères (la forme emboîtée) de la protéine Orb2 augmente dans les neurones de la mouche drosophile qui sont stimulés à répétition, ce qui simule un apprentissage. De plus, cette augmentation se produit exactement au niveau des synapses des neurones. La manipulation décisive a toutefois été de démontrer que chez les mouches dont le gène de la protéine Orb2 a été muté pour empêcher celle-ci de former des oligomères, la capacité de former des souvenirs à long terme a été perdue.
Le défi suivant sera de démontrer pendant combien de temps les oligomères d’Orb2 sont nécessaires pour garder la trace mnésique accessible. Et l’hypothèse est que les oligomères d’Orb2 ont besoin d’être toujours là, ce qui est justement possible pour eux grâce à leur capacité constante de s’emboîter les uns dans les autres et de maintenir ainsi la chaîne d’oligomères au fil du temps.
Une capacité que l’on retrouve chez d’autres protéines associées à des dysfonctions neuronales comme l’Alzheimer, où la protéine bêta-amyloïde se retrouve, comme pourla protéine Orb2, sous deux formes : une très encline à former des oligomères et une autre plus inerte. La maladie de Parkinson, dHuntington ou encore des maladies causées par des prions comme la maladie de Creutzfeldt-Jakob pourraient aussi dépendre, selon les auteurs de l’étude, de la peut-être trop grande hospitalité du cerveau pour la formation d’oligomères, un mécanisme qui, comme on vient de le voir, peut lui être fort utile par ailleurs…
![]() Making Memories Last
Making Memories Last
![]() Critical Role of Amyloid-like Oligomers of Drosophila Orb2 in the Persistence of Memory
Critical Role of Amyloid-like Oligomers of Drosophila Orb2 in the Persistence of Memory
Au coeur de la mémoire | 2 commentaires »









Bjr
Avez vous des nouvelles pour la maladie de Parkinson?
Je suis phytotherapeute et je viens de découvrir votre site
Cordialement Mme Belestin
Le tango du Parkinson
Peut-être ceci, trouvé hier par hasard :
Réduire les problèmes liés à la maladie de Parkinson en dansant le tango argentin? Efficace, répondent des experts en neurologie et en motricité de Montréal. Un reportage de Yanick Villedieu.
Invités :
Dr Ronald Postuma, neurologue à l’Hôpital général de Montréal
http://ici.radio-canada.ca/emissions/les_annees_lumiere/2014-2015/
Le tango de l’Alzheimer : Danser pour ralentir la maladie